ナノ医療イノベーションセンター(iCONM)は11日、同センター副主幹研究員の内田智士氏(京都府立医科大学准教授)らの研究グループが、「CRISPR/Cas9(クリスパー・キャスナイン)」の送達手法を開発し、マウス脳内での効率的なゲノム編集に成功したと発表した。
ゲノム編集治療は、1回の治療で永続的な効果をもたらす画期的な治療であり、mRNAを活用すれば安全性の高いゲノム編集治療が可能となる。今回の研究成果は、RNAを基盤としたCRISPR/Cas9送達で脳実質細胞へのゲノム編集を確認した世界で初めての報告となる。
今後、ハンチントン病(舞踏病)やアルツハイマー型認知症のような長期に渡り病勢進行する難治性脳疾患に新たな治療選択肢の提供が期待される。
CRISPR-Cas9は、ゲノムの正確な切断や、切断し箇所に別の遺伝情報の組み入れが可能なゲノム編集手法で、開発者のエマニュエル・シャルパンティ氏(仏)とジェニファー・ダウドナ氏(米)は、2020年にノーベル化学賞を受賞している。
内田氏らの研究では、臨床応用可能な安全性を得るため、新型コロナウイルス感染症の予防ワクチンとしても注目されているメッセンジャーRNA(mRNA) を用いている。
遺伝子の異常で、有害なタンパク質ができたり、逆に必要なタンパク質ができなくなるような先 天性の遺伝性疾患は、Unmet Medical Needs の典型的なものだが、遺伝子そのものを治療する遺伝子治療が現実的なものとなり期待が寄せられている。
その中で、CRISPR/Cas9 は標的となる遺伝子を簡便に編集できるツールとして脚光を浴び、今後、様々な難病治療への応用が期待できる。その一方で、Cas9タンパク質の標的組織への送達は容易でなく、また、その抗体産生のリスクもある。
そこで、内田氏らは、Cas9タンパクをコードするmRNAと遺伝子編集部位を特定するガイドRNA (gRNA)を、iCONM独自の技術である高分子ナノミセルに搭載させて脳実質細胞へ送達し発現させる研究を進めてきた。
その結果、効率よくCas9 タンパク質が脳内で発現し、ゲノム編集を簡便に行えることが実証されたことで、Saed Abbasi 研究員を筆頭著者として、国際的な学術誌 J. Controlled Release(IF = 7.727)に 3/4 論文掲載(https://doi.org/10.1016/j.jconrel.2021.02.026)している。
同研究では、遺伝子(ゲノム)の編集が起きると赤色蛍光タンパク質が作られるように遺伝子改変したマウスを用いて、脳実質細胞内でのゲノム編集効果を評価した。Cas9mRNA は、4500 塩基からなり、100塩基程度の長さしかないgRNAとはサイズが大きく異なる。
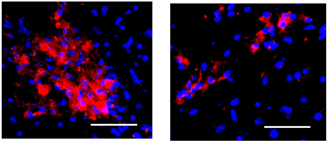
それぞれのmRNAを別々のナノミセルに搭載させると、gRNAの一部がミセルから漏出する現象が観察された。そこで、同一のナノミセルに両者を載せて脳内に投与したところ、図1に示す赤色蛍光が広範囲で観察でき、ゲノム編集が確実に起きていることを実証した。
細胞別に調べると、神経細胞(ニューロン)の他に、アストロサイトやミクログリアにおいてもゲノム編集が行われていることがわかり、広範囲の細胞種に対しての効果的な働きが判った。
同研究成果は、RNAを基盤とした CRISPR/Cas9送達で、脳実質細胞のゲノム編集に成功した世界で初めての報告となる。
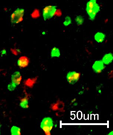
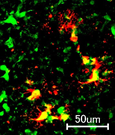
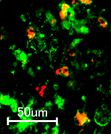
mRNAを基盤としたCRISPR/Cas9の送達で、様々な脳実質細胞に
対してゲノム編集 世界初!


